Dra. Célia Regina da Silva - CRM 41959-1
Coordenadora de Genitoscopia da Maternidade Escola da UFRJ
Delegada da SOBRAGE – Rio de Janeiro
Mestre em Ginecologia – FCMSCMSP
Dr. Hugo Maia Filho - CRM 5239
Professor de Reprodução Humana na UFBa Faculdade de Medicina de 1980 a 2015
Coordenador Médico do Instituto da Mulher Itaigara
Memorial Hospital Dia
Doutor em Medicina pela Universidade Federal da Bahia
A endometriose é uma doença ginecológica bastante comum, sendo considerada uma patologia benigna na fase reprodutiva da mulher. Define-se endometriose como a presença de glândulas e estroma endometrial em localização extrauterina, o que induz uma reação inflamatória crônica nos tecidos afetados.1 Sua principal característica é provocar dor: dor pélvica crônica, dismenorreia, dispareunia. Esses sintomas dolorosos têm sido vinculados a uma deterioração na qualidade de vida das mulheres afetadas.2
Estima-se que a endometriose acomete aproximadamente 10% a 15% das mulheres em período reprodutivo, cerca de 40% das mulheres com dor pélvica e 50% das mulheres com problemas de fertilidade.2
Clinicamente, a endometriose é uma doença crônica de natureza infl amatória, na maior parte das vezes debilitante e recorrente, e que não pode ser tratada como uma patologia na sua vida reprodutiva para a qual existiria uma forma definitiva e única de tratamento.3,4,5
Fatores genéticos foram inicialmente sugeridos e existem relatos que indicam probabilidade familiar, principalmente em parentes de primeiro grau, com risco estimado de 6,9%, sendo a apresentação geralmente mais grave, bilateral e de surgimento mais precoce.6
Porém, a sua patogênese ainda não está completamente esclarecida, já que permanecem as controvérsias relacionadas a vários aspectos desta doença, e que podem impedir a eficácia do seu tratamento a longo prazo.7
São várias as teorias apontadas para explicar a origem dos implantes endometrióticos, das quais a teoria da menstruação retrógrada (ou de Sampson) permanece a mais consensual (Figura 1).7
Existe também a teoria que consiste na propagação linfática ou vascular, desenvolvida com o intuito de explicar a presença da endometriose em sítios distantes, como implantes no pulmão e cérebro, tomando como base a via de disseminação do câncer de endométrio.8
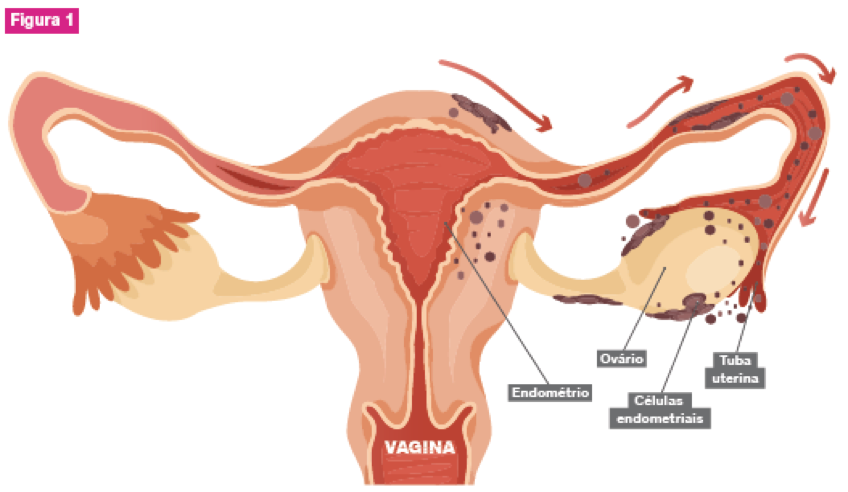
A menstruação retrógrada é um fenômeno quase universal, mas não leva ao desenvolvimento da endometriose em todas as mulheres. Uma explicação recente para esta questão é de que ocorrem alterações epigenéticas nas células endometriais das pacientes com endometriose, permitindo o seu desenvolvimento.7
Sob esta ótica, a endometriose seria considerada uma patologia inicialmente endometrial, que dependeria da ocorrência da menstruação retrógrada para que estas células modificadas epi geneticamente fossem transportadas da cavidade uterina para a pelve, onde se implantariam e sobreviveriam nestes sítios ectópicos.7
Por isso, é uma condição patológica que pode ser controlada, mas nunca completamente curada, uma vez que novas células endometriais modificadas epi geneticamente são levadas através da menstruação retrógada para dentro da cavidade pélvica onde se implantam e iniciam a formação das lesões de endometriose.9
Estas sucessivas ondas de células endometriais que chegam à cavidade uterina através da menstruação retrógrada são responsáveis pela progressão e persistência da doença na qual a inflamação exerce um papel importante na manutenção destas alterações epigenéticas que tornam as células endometriais das pacientes com endometriose diferentes daquelas das pacientes que não apresentam esta patologia.9,10
Nas pacientes com endometriose, ocorrem diversas alterações na expressão gênica no endométrio, levando ao aparecimento de alterações funcionais e enzimáticas que favorecem o aumento da inflamação e a produção de estradiol por estas células.9,10
Estas alterações favoreceriam a sobrevivência das células endometriais fora da cavidade uterina e o consequente desenvolvimento da endometriose.9,10
Uma das mais importantes alterações epigenéticas nessas pacientes é a capacidade que o seu endométrio adquire de produzir estrogênios localmente.1,3,4,5,6
Isso fica ainda mais evidente quando não se observa endometriose antes da menarca, por ser doença rara em mulheres com ciclos anovulatórios e haver diminuição ou controle da doença na menopausa e na utilização de análogos de GnRH.2
Sabemos atualmente que estas alterações no metabolismo local dos estrogênios seriam resultantes da capacidade do endométrio passar a expressar a enzima aromatase principalmente no estroma, através destas alterações epigenéticas que ativam a transcrição do gene que codifica esta enzima no endométrio.9,10,11,12
Resumidamente, a expressão aumentada da enzima aromatase e a diminuição da expressão de 17 β-HSD (17 β hidroxiesteroidedesidrogenase) no tecido endometrioide, levam ao aumento expressivo da biodisponibilidade de estrógeno (E2), que por consequência estimula a produção de PGE2 (prostaglandina E2) e esta, por sua vez, estimula a ação da aromatase, ou seja, uma retroalimentação das citocinas pró-inflamatórias.
Também há evidências de resistência à progesterona, com número reduzido de expressão de receptores progestínicos e ausência de receptores de progesterona tipo B (Figura 2).1,10
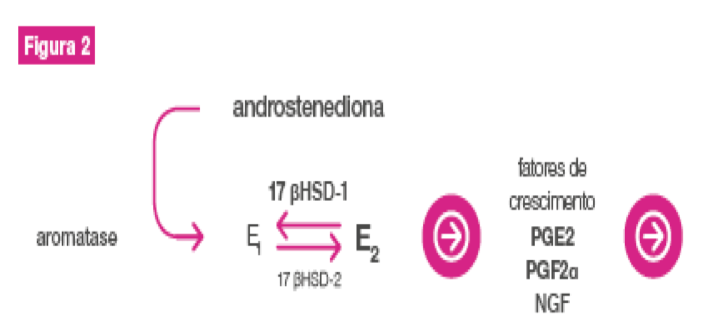
Referência: Burney e Giudice. Produção local de estradiol na lesão endometriótica e infl amação eutópica do endométrio e dor. 17β–HSD = 17 β hidroxiesteroidedesidrogenase; E1 = Estrona; E2 = Estradiol; PGE2 = Prostaglandina E2; PGF2α = Prostaglandina F2α; NGF= Fator de crescimento do nervo.
A elevação da aromatase diminui a ação de 17 β-hidroxiesteroide desidrogenase e, com isso, eleva o estradiol local, elevando também a produção de substâncias pró inflamatórias - PGE2, PGF2α, NGF - e ocasionando adesão, proliferação, anti-apoptose, angiogênese, neurogênese, disseminação neuronal e inflamação, o que leva à dor.
Existem evidências de que a expressão da enzima aromatase é maior tanto no tecido endometrial como nas lesões endometrióticas mais ativas e com um curso clínico mais agressivo. Estes achados estão também de acordo com observações de que a expressão de aromatase não é detectável no endométrio de mulheres que não têm a doença, mas está presente no endométrio de pacientes com endometriose e outras patologias, como adenomiose, pólipos endometriais e miomas que frequentemente coexistem com a endometriose. A expressão de aromatase no endométrio eutópico seria, portanto, um importante marcador desta patologia e dos seus sintomas no nível endometrial além de ter um importante papel no desenvolvimento e agressividade clínica da endometriose.9,10,11,13
As mudanças imunológicas na cavidade peritoneal e na circulação foram apontadas na patogênese da endometriose, além de associação de doenças ditas autoimunes. Há coexistência de lúpus, artrite reumatoide, síndrome de Sjögren, doenças tireoidianas autoimunes, além de doenças atópicas, como alergias, asma e eczema com endometriose. A endometriose está associada a alterações tanto na resposta inata quanto adquirida do sistema imunológico. Produtos secretados de macrófagos peritoneais e monócitos circulantes parecem mediar o crescimento do endométrio ectópico. Estudos confirmaram aumento da atividade macrofágica peritoneal. Células NK (Natural Killers), importantes componentes do sistema imune inato, estão em menor número na endometriose moderada a severa, apesar de estudos terem resultados conflitantes quanto a este achado. Também o endométrio eutópico de mulheres endometrióticas demonstrou ser mais resistente à lise por células NK do que endométrio eutópico de mulheres sem a doença. Sabe-se que linfócitos T são encontrados em maior concentração no fluido peritoneal e em implantes de mulheres com endometriose.14
Podemos afirmar que a endometriose pode ser considerada doença inflamatória e epigenética. Medicamentos que suprimam a expressão de aromatase ou modulem a atividade imunológica terão um papel importante na terapia da endometriose.10
O dienogeste (DNG) mostrou ser um progestógeno que tem uma ação altamente seletiva no endométrio quando comparada aos demais, além de ser capaz de inibir a expressão anômala da enzima aromatase no endométrio.14
Com isto, o dienogeste conseguiria reverter, enquanto utilizado, estas alterações epigenéticas que ocorrem no endométrio eutópico e que são importantes para a progressão da endometriose. O uso contínuo do dienogeste seria uma maneira eficaz de controlar esta patologia, pois o defeito endometrial que levou ao aparecimento da aromatase no endométrio pode envolver alterações epigenéticas que seriam reversíveis com o uso deste hormônio.9,14
Publicações recentes mostraram que o dienogeste inibe não somente a expressão da enzima aromatase no endométrio, mas também inibe a ativação do fator inflamatório NF-Kappa B. Como consequência, o uso do dienogeste leva a uma diminuição desta cascata inflamatória presente no endométrio e nas lesões de endometriose. O bloqueio do NF-Kappa B pelo dienogeste leva a uma redução da atividade da Cox-2 no endométrio e na endometriose, reduzindo assim a dor, a inflamação e a produção de prostaglandinas pró inflamatórias. O dienogeste também inibe a produção de fatores angiogênicos como VEGF, diminuindo assim a inflamação e progressão das lesões de endometriose por causa do bloqueio da vascularização. O bloqueio da aromatase com o uso do dienogeste impediria esta produção local de estrogênios.15-19
O dienogeste induz à inibição total da ovulação, no entanto, sem a adição do estrógeno. Como não foi desenvolvido com o intuito contraceptivo, não deve ser usado como monoterapia em paciente que não deseja gestar. A atividade ovariana é restaurada após 1 a 43 dias da suspensão da medicação.2
Os diversos estudos com DNG como tratamento da endometriose mostraram que 2 mg/dia em dose oral são equivalentes a outros tratamentos considerados como padrão-ouro, como é o uso do Gn-RH no tocante à redução da dor associada a endometriose. A boa tolerabilidade e os efeitos adversos discretos justificam o seu uso por períodos prolongados.15
Além disso, o DNG não tem propriedades androgênicas nem estrogênicas e apresenta uma atividade antiandrogênica sem atividade glicocorticoide,16,17 o que leva a, teoricamente, apresentar menor risco de tromboembolismo venoso ou arterial.17
O mais importante no uso para tratamento da endometriose é o forte efeito progestacional sobre o endométrio.18
Referências Bibliográficas
1. Burney, RO; Giudice C. L. – Pathogenesis and Pathophysiology of Endometriosis. Feril Steril. v.98, 2013.
2. Bahamondes L., Camargo AF. Dienogest: Uma nova opção terapêutica em endometriose. Femina, maio/junho 2012.
3. Acien P, Velasco I, Gutierrez M, Martinez-Beltran M. Aromatase expression in endometriotic tissues and its relationship to clinical and analytical fi ndings. Fertil Steril. 2007;88(1):32-8.
4. Amsterdam LL, Gentry W, Jobanputra S, Wolf M, Rubin SD, Bulun SE. Anastrazole and oral contraceptives: a novel treatment for endometriosis. Fertil Steril. 2005; 84 (2):300-4.
5. Attar E. Aromatase and other steroidogenic genes in endometriosis. Translational aspects. Human Reproduction Update 2006; 12:49-56.
6. Burney RO - The genetics and biochemistry of endometriosis. Wolters Kluwer Health. V.25, p.511–519, 2013.
7. Redwine D. Sampson revisited: A critical review of the development of Sampson’s theory of origin of endometriosis. In ENDOMETRIOSIS – Current management and future trends. Jaypee Brothers Medical Publishers, 2010.
8. Schorge, J O. Ginecologia de Williams. 1 ed. Porto Alegre: Artmed, 2011.
9. Maia H Jr, Haddad C, Coelho G, Casoy J. Role of inflammation and aromatase expression in the eutopic endometrium and its relationship with the development of endometriosis. Women’s Health (Lond). 2012
10. Maia H Jr, Casoy J, Valente J. Is aromatase expression. in the endometrium the cause of endometriosis and its related infertility? Gynecol. Endocrinol 2010;26(4):253-7.
11. Nasu K, Kawano y,Tsukamoto y, Takano M, et al- Aberrant DNA methylation status in endometriosis: epigenetics as the pathogenesis, biomarker and therapeutic target. J Obstet Gynecol Res 2011;37;683-95
12. Kawano Y, Nasu K,Li H, Tsuno A, Abe W, Takai N, Narahara H - Application of the histone deacetylase inhibitora for the treatment of endometriosis: histone modification as pathogenesis and novel therapeutic target. Hum. Reprod. 2011: 26: 2486-98
13. Maia H Jr, Haddad C, Casoy J. Correlation between aromatase expression in the eutopic endometrium and the presence of endometriosis. Int. J. Womens health 2012; 4: 61-5
14. Yamanaka K, Xu B, Suganuma I et al. Dienogest inhibits aromatase and cycloooxigenase-2 expression and prostaglandin E2 production in human endometriotic stroma cells in spheroid culture. Fertil. Steril. 2012; 97(2); 477-82.
15. Harada T, Taniguchi F. Dienogest: a new therapeutic agent for the treatment of endometriosis. Womens Health (Lond Engl).;6:27-35, 2010
16. Klipping C, Duijkers I, Faustmann T, Klein SF, Schuett B. Pharmacodynamic study of four oral dosages of dienogest. Fertil Steril. 2010; 94 (Suppl 1): S181.
17. Whalen KL, Rose R. Estradiol valerate/dienogest: a novel oral contraceptive. Ann Pharmacother. 2011; 45(10): 1256-61.
18. Sasagawa S, Shimizu Y, Kami H, Takeuchi T, Mita S, Imada K, et al. Dienogest is a selective progesterone receptor agonist in transactivation analysis with potente oral endometrial activity due to its effi cient pharmacokinetic profile. Steroids 2008; 73(2): 222-31.
19. Maia H Jr, Casoy J, Correia T, Freitas A, Pimentel K, Coutinho EM. Effect of the menstrual cycle and oral contraceptives on aromatase and Cox-2 expression in adenomyosis. Gynecological Endocrinology 2006; 22: 1-5. -
