Caso clínico
Diabetes e manejo da neuropatia
Dr. Miguel Madeira - CRM/RJ 52-76.153-2 | RQE 28.445
Médico pela Universidade Federal do Rio de Janeiro (UFRJ). Residência e título de Especialista em Endocrinologia. Mestrado em Medicina (Endocrinologia) e Doutorado pela UFRJ. Professor adjunto da Faculdade de Medicina da UFRJ e da Universidade do Grande Rio.
CASO CLÍNICO
• Identificação: paciente do sexo masculino, 67 anos de idade, branco, solteiro, comerciante, natural e residente no Rio de Janeiro.
• História da doença atual: paciente compareceu ao atendimento médico apresentando “dor nas pernas”. Relatou início do quadro havia dez meses, com piora progressiva. Referiu que as queixas se iniciaram como parestesia bilateral dos pés aos joelhos, sem fatores predisponentes ou de melhora. Queixas álgicas (em queimação) se associaram ao quadro nos últimos dois meses, ocorrendo com a mesma intensidade em ambos os membros inferiores e caracterizando- se por piora noturna, sem fatores de melhora e interrompendo frequentemente o sono. Negou lesões prévias em membros inferiores, síncope, precordialgia ou claudicação intermitente.
• História patológica pregressa: diabetes mellitus tipo 2 diagnosticado há 16 anos, em uso de metformina (2.550 mg/dia) + glimepirida (4 mg/dia). Hipertensão arterial diagnosticada há 20 anos, em uso regular da losartana (50 mg/dia) + hidroclorotiazida (25 mg/dia). Dislipidemia diagnosticada há 13 anos, em uso regular de atorvastatina (40 mg/dia). Negou cirurgias, alergias ou outras comorbidades.
• História familiar: pai apresentou acidente vascular encefálico aos 66 anos, mãe faleceu aos 70 anos por infarto agudo do miocárdio, irmão (67 anos) e pai (88 anos) apresentaram diabetes mellitus (DM) tipo 2 há 10 e 25 anos, respectivamente.
• História fisiológica: não pratica atividade física regular há 12 anos e negou tabagismo ou etilismo.
• Exame físico: corado, hidratado, acianótico, anictérico, com enchimento capilar preservado.
• Pressão arterial: 130 x 74 mmHg; frequência cardíaca: 81 bpm; altura: 1,72 m; peso: 93 kg; índice de massa corporal: 31,41 kg/m2; circunferência abdominal: 103 cm. Reanimação cardiorrespiratória em dois tempos, bulhas normofonéticas, sem sopros ou extrassístoles; ausência de sopros carotídeos.
Pulsos pediosos e tibiais posteriores palpáveis e isóbaros. Onicomicose em segundo e terceiro pododáctilos direitos, sem outras lesões. Teste do monofilamento (10 g) identificou redução da sensibilidade protetora plantar bilateralmente. Reflexos profundos de membros inferiores preservados. Sensibilidades térmica, dolorosa e de vibração preservadas.
Restante do exame físico não apresentou alterações. Paciente trouxe exames complementares (Tabela 1).
Tabela 1. Exames complementares
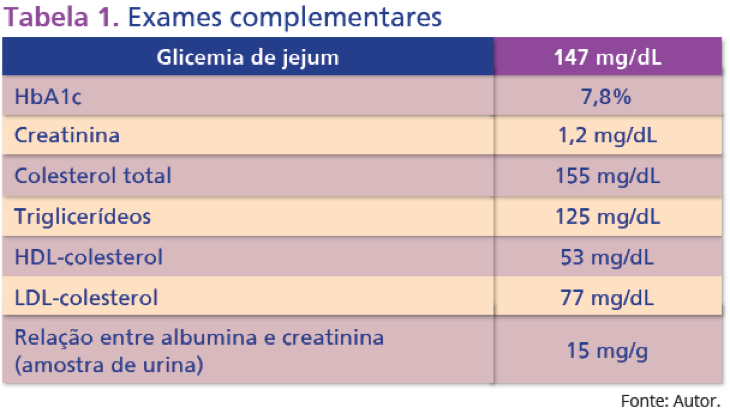
Optou-se, então, pela manutenção de metformina e troca de glimepirida por liraglutida (progressão semanal da dose de 0,6 até 1,8 mg/dia). Administrou-se pregabalina (300 mg/dia) para tratar dor neuropática.
Após três meses, paciente retornou com melhora parcial das queixas álgicas em membros inferiores, com dor menos intensa e frequente. Contudo, os episódios de dor ainda atrapalhavam seu sono e promoviam astenia durante o dia. Perdeu 7 kg no período, por meio de melhora do padrão alimentar e início de atividades físicas. Exames mais recentes evidenciaram também adequado controle da glicemia (glicose = 106 mg/dl; HbA1c = 6,8%), além de ácido fólico, função tireoidiana, hemograma, eletrólitos e imunoeletroforese de proteínas séricas normais. Dosagem sérica de vitamina B12 estava próximo ao limite inferior da normalidade (304 pg/mL; valor de referência: 300 a 900 pg/mL). A conduta foi manter as demais medicações e acrescentar Betrat® (100 mg de tiamina + 100 mg de piridoxina + 5.000 μg de cianocobalamina _ 1 comprimido no café, no almoço e no jantar).
Em uma nova avaliação após três meses, paciente referiu melhora completa da parestesia e das dores em membros inferiores, possibilitando adequado repouso à noite e retorno às atividades cotidianas. Manteve mudanças de estilo de vida e perdeu mais 5 kg. Foram mantidas orientações e tratamento medicamentoso.
Como se deve avaliar e tratar a neuropatia diabética?
O acometimento dos nervos por DM ou neuropatias diabéticas (NDs) são as complicações crônicas mais prevalentes, podendo afetar mais de 50% dos pacientes, dependendo da avaliação implementada. Caracterizam-se pela presença de sinais e/ou sintomas de disfunção do sistema nervoso periférico somático e/ou do autonômico em indivíduos com DM e são consideradas diagnóstico definitivo após a exclusão de outras causas de neuropatias, como as resultantes de doenças metabólicas, sistêmicas, infecciosas, inflamatórias, nutricionais ou hereditárias.¹
Podem acometer todos os tipos de fibras nervosas, promovendo as manifestações clínicas mais diversas. O diagnóstico e o adequado manejo das NDs podem atenuar sintomas, reduzir sequelas e melhorar a qualidade de vida.²
A classificação das NDs definida pela Associação Americana de Diabetes (ADA) e referendada pela Sociedade Brasileira de Diabetes consta no Quadro 1.
A polineuropatia (PNP) difusa simétrica é a forma mais frequente de ND, correspondendo a 75% dos casos. Uma definição simples de PNP difusa simétrica para a prática clínica é a presença de sintomas e/ou sinais de disfunção nervosa periférica em indivíduos com DM, após a exclusão de outras causas. Pode estar presente em 10% a 15% dos pacientes com DM2 recém-diagnosticados, com incremento para 50% após dez anos de duração da doença.3-5
A maioria dos pacientes com PNP somática crônica apresenta-se assintomática, mas cerca de 10% podem ter sintomas sensitivos incapacitantes, necessitando de tratamento específico. Embora comumente não apresentem dor em resposta estímulos nociceptivos, pacientes com ND podem sentir dores neuropáticas, principalmente parestesias ou hiperestesias. Queixas álgicas costumam ser mais intensas à noite, levando à insônia e à consequente astenia diurna. Em alguns pacientes com ND, a dor é leve ou inexistente, sendo a PNP detectada como déficit neurológico ao exame físico ou como complicação resultante de alterações neurológicas assintomáticas.¹
O exame clínico é suficiente para definir a presença de PNP na maioria das vezes. Quando o exame clínico não for definitivo, será necessário realizar exames complementares (como eletroneuromiografia) para determinar se a dor é ou não resultado da presença de ND. O exame físico geralmente revela déficit sensitivo originando-se nas regiões plantares dos pés e direcionando-se para as pernas (distribuição em meias ou em botas). Algumas vezes, sinais de disfunção motora podem estar presentes, com fraqueza muscular e reflexos profundos diminuídos ou ausentes.1 As recomendações atuais da ADA para rastreamento e diagnóstico das PNPs distais simétricas são:²
• Todos os pacientes devem ser avaliados quanto à PNP distal simétrica, à época do diagnóstico do DM2 e cinco anos após o diagnóstico do DM1, e pelo menos anualmente depois disso;
• A avaliação deve incluir histórico cuidadoso e pesquisa de sensibilidade à temperatura ou toque pontiagudo com palito (pinprick, função da fibra fina) e sensibilidade de vibração com diapasão de 128 Hz (função da fibra grossa).


Adaptado de: Pop-Busui R, et al . 2017.²
Todos os pacientes devem ser testados anualmente com monofilamento de 10 g para avaliar o risco de ulceração e amputação;
• Testes eletrofisiológicos ou encaminhamento ao neurologista raramente são necessários para rastreamento, exceto em situações clínicas atípicas, como quando o diagnóstico não é claro ou se há suspeita de etiologia diferente. Características atípicas incluem neuropatia motora predominando sobre a sensitiva, início rápido de sintomas ou apresentação clínica assimétrica.
Opções consideradas de primeira linha para o tratamento medicamentoso da PNP incluem fármacos de três classes: ligantes da subunidade α2-δ dos canais de cálcio (pregabalina e gabapentina), inibidores da recaptação de serotonina e noradrenalina (duloxetina e venlafaxina) e antidepressivos tricíclicos (amitriptilina e nortriptilina). No caso em questão, optou-se pela pregabalina por seu bom perfil de eficácia versus efeitos adversos (os mais frequentes são cefaleia, sonolência, tontura e ganho de peso). As vitaminas B1 (tiamina), B6 (piridoxina) e B12 (cianocobalamina) podem participar da fisiopatologia da ND. Em modelos experimentais, a tiamina inibe as vias de AGES (advanced glycation end products), a da hexosamina e a da proteína quinase C/diacilglicerol. A deficiência de tiamina se associou a fatores de risco cardiovasculares, como diabetes, obesidade e dislipidemia, além de também à insuficiência cardíaca, a infarto agudo do miocárdio e à depressão. Em dois ensaios clínicos com 40 e 100 pacientes com DM2 e microalbuminúria, foi utilizada dose diária de 300 mg de tiamina por três meses e os resultados demonstraram regressão na excreção urinária de albumina.6 Em outros estudos, o uso de tiamina foi mais eficaz que placebo em indivíduos com sintomas neuropáticos.7,8
O uso crônico de doses elevadas de metformina relaciona-se com redução dos níveis de vitamina B12. Em idosos, esse fato pode se tornar um problema ainda mais significativo, predispondo ao surgimento ou agravamento de neuropatias. Dessa forma, orienta-se a solicitação periódica de dosagem sérica de vitamina B12 em idosos em uso de metformina.¹
Há, ainda, a hipótese de que vitaminas do complexo B (ácido fólico, vitaminas B12 e B6) poderiam reduzir o risco de doenças cardiovasculares ao diminuir os níveis de homocisteína.9 Assim, diversos ensaios clínicos avaliaram a segurança e a eficácia de doses suplementares de vitaminas do complexo B para reduzir o risco de doença cardíaca. Como exemplo, o estudo Heart Outcomes Prevention Evaluation 2 (HOPE 2), que incluiu mais de 5.500 adultos com doença cardiovascular conhecida, identificou que a suplementação por cinco anos com vitaminas B6 e B12 e ácido fólico reduziu os níveis de homocisteína e o risco de acidente vascular cerebral em cerca de 25%.10 No caso apresentado, o paciente utilizava dose plena de metformina, com níveis séricos de B12 limítrofes, além de resposta incompleta de dor neuropática com pregabalina.
Conclusão
Dessa forma, a opção pela suplementação associada de vitaminas do complexo B (Betrat®) possibilitou remissão completa dos sintomas neuropáticos e consequente melhora da qualidade de vida do paciente.
Referências bibliográficas:
1. Sociedade Brasileira de Diabetes – Diretrizes 2019-2020. Disponível em: https://www.diabetes.org.br/profissionais/images/DIRETRIZES-COMPLETA-2019-2020.pdf. Acesso em: 23 jun 2020. 2. Pop-Busui R, Boulton AJ, Feldman EL, Bril V, Freeman R, Malik RA, et al. Diabetic neuropathy: a position statement by the American Diabetes Association. Diabetes Care. 2017;40(1):136-54. 3. Ang L, Jaiswal M, Martin C, Pop-Busui R. Glucose control and diabetic neuropathy: lessons from recent large clinical trials. Curr Diab Rep. 2014;14(9):528. 4. Young MJ, Boulton AJ, MacLeod AF, Williams DR, Sonksen PH. A multicentre study of the prevalence of diabetic peripheral neuropathy in the United Kingdom hospital clinic population. Diabetologia. 1993;36(2):150-4. 5. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet. 1998;352(9131):837-53. 6. Eshak ES, Arafa AE. Thiamine deficiency and cardiovascular disorders. Nutr Metab Cardiovasc Dis. 2018;28(10):965-72. 7. Stracke H, Gaus W, Achenbach U, Federlin K, Bretzel RG. Benfotiamine in diabetic polyneuropathy (BENDIP): results of a randomised, double blind, placebo-controlled
clinical study. Exp Clin Endocrinol Diabetes. 2008 13;116(10):600-5. 8. Fraser DA, Diep LM, Hovden IA, Nilsen KB, Sveen KA. The effects of long-term oral benfotiamine supplementation on peripheral nerve function and inflammatory markers in patients with type 1 diabetes. Diabetes Care. 2012;35(5):1095-7. 9. Ebbing M, Bonaa KH, Arnesen E, Ueland PM, Nordrehaug JE, Rasmussen K, et al. Combined analyses and extended follow-up of two randomized controlled homocysteine-lowering B-vitamin trials. J Intern Med. 2010 1;268(4):367-82. 10. Saposnik G, Ray JG, Sheridan P, McQueen M, Lonn E. Homocysteine-lowering therapy and stroke risk, severity, and disability: a dditional findings from the HOPE 2 trial. Stroke. 2009;40(4):1365-72.
As opiniões emitidas nesta publicação são de inteira responsabilidade do autor e não refletem, necessariamente, a opinião da Conectfarma® Publicações Científicas Ltda. nem do Laboratório Myralis.
